Octaossido di triuranio
In questo articolo esploreremo in modo approfondito il tema Octaossido di triuranio, analizzandone le origini, l'evoluzione e l'attualità oggi. Octaossido di triuranio è un argomento che ha suscitato grande interesse in diversi ambiti, dalla scienza alla cultura popolare. Nel corso della storia, Octaossido di triuranio ha svolto un ruolo fondamentale nella società, influenzando diversi aspetti della vita moderna. Attraverso questo articolo cercheremo di far luce sugli aspetti più rilevanti di Octaossido di triuranio, con l'obiettivo di fornire un panorama completo e aggiornato su questo argomento.
| Octaossido di triuranio | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | U3O8 |
| Massa molecolare (u) | 842,08 |
| Aspetto | solido con colorazione da verde oliva a nero |
| Numero CAS | |
| Numero EINECS | 215-702-4 |
| PubChem | 11968241 e 92028829 |
| SMILES | .......... |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 8,38 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 1150 °C con decomposizione |
| Temperatura di ebollizione | 1300 °C (1573,15 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −3575 |
| S0m(J·K−1mol−1) | 282 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | 300 - 330 - 373 - 411 |
| Frasi S | 1/2-20/21-45-61 |
L'octaossido di triuranio (U3O8) è un ossido dell'uranio in cui quest'ultimo elemento è formalmente presente negli stati di ossidazione +4 e +6, quindi è idealmente rappresentabile come UO2·2UO3. Si presenta come un solido di colorazione che va dal verde oliva al nero, inodore. È una delle forme più popolari di yellowcake e viene spedita dalla fabbrica alle raffinerie in questa forma.
L'octaossido di triuranio ha una potenziale stabilità a lungo termine in un ambiente geologico e in natura è presente nella pechblenda. In presenza di ossigeno (O2), il diossido di uranio (UO2) si ossida a octaossido di triuranio, mentre il triossido di uranio (UO3) perde ossigeno a temperature superiori a 500 °C e si riduce a octaossido di triuranio. Il composto può essere prodotto mediante uno qualsiasi dei tre processi di conversione chimica primaria, che coinvolgono tetrafluoruro di uranio (UF4) o fluoruro di uranile (UO2F2) come intermedi. È generalmente considerata la forma più interessante ai fini dello smaltimento perché, in condizioni ambientali normali, l'octaossido di triuranio è una delle forme di uranio più cineticamente e termodinamicamente stabili. La sua densità delle particelle è 8,3 g cm-3.
L'octaossido di triuranio viene convertito in esafluoruro di uranio (UF6) ai fini dell'arricchimento dell'uranio.
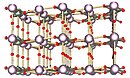
Struttura allo stato solido
Il solido è una struttura a strati in cui gli strati sono collegati da atomi di ossigeno; ogni strato contiene atomi di uranio che si trovano in diversi ambienti di coordinazione.
Studio sulla valenza di legame
Utilizzando una scatola 6Å x 6Å x 6Å con l'atomo di uranio al centro, il calcolo della valenza del legame è stato eseguito sia per U1 che per U2 nel solido. È stato trovato, utilizzando i parametri per U(VI), che gli stati di ossidazione calcolati per U1 e U2 sono 5,11 e 5,10. Utilizzando i parametri per U(IV), gli stati di ossidazione calcolati sono 5,78 e 5,77 rispettivamente per U1 e U2. Questi studi suggeriscono che tutti gli atomi di uranio hanno lo stesso stato di ossidazione, in modo che gli stati di ossidazione siano disordinati attraverso il reticolo.[senza fonte]
Note
- ^ a b (EN) Zumdahl, Steven S., Chemical Principles, 6ª ed., Houghton Mifflin Company, 2009, p. A23, ISBN 0-618-94690-X.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Octaossido di triuranio
Wikimedia Commons contiene immagini o altri file su Octaossido di triuranio