Hell-Volhard-Zelinsky-Reaktion
In diesem Artikel tauchen wir in die spannende Welt von Hell-Volhard-Zelinsky-Reaktion ein und erforschen seine Ursprünge, seine heutige Relevanz und seine möglichen Auswirkungen in der Zukunft. Seit seiner Einführung hat Hell-Volhard-Zelinsky-Reaktion das Interesse und die Neugier von Menschen aller Altersgruppen und Berufe geweckt und ist zu einem wiederkehrenden Thema in Gesprächen, Debatten und akademischen Studien geworden. In diesem Artikel werden wir uns mit den wichtigsten Aspekten von Hell-Volhard-Zelinsky-Reaktion befassen, seine Auswirkungen in verschiedenen Kontexten analysieren und einen kritischen Blick auf seinen Einfluss auf die heutige Gesellschaft werfen. Durch einen umfassenden Ansatz werden wir versuchen, unseren Lesern ein umfassenderes Verständnis von Hell-Volhard-Zelinsky-Reaktion und seinen Auswirkungen in der heutigen Welt zu vermitteln.
Die Hell-Volhard-Zelinsky-Reaktion oder auch Zelinsky-Reaktion ist eine Namensreaktion in der organischen Chemie. Bei dieser nach Carl Magnus von Hell (1849–1926) (Veröffentlichung 1881), Jacob Volhard und Nikolaj Dimitrievic Zelinskij (Erweiterung der Reaktion 1887) benannten Reaktion wird ein Wasserstoffatom am α-Kohlenstoffatom einer Carbonsäure durch ein Halogen (zumeist Brom) ersetzt.
Übersichtsreaktion
Dabei wird die Carbonsäure mit einem Halogen und einer katalytischen Menge eines Phosphorhalogenids versetzt. Es entsteht eine α-Halogencarbonsäure. Wenn man z. B. Brom und katalytische Mengen PBr3 einsetzt, erhält man eine α-Bromcarbonsäure (2-Bromcarbonsäure):
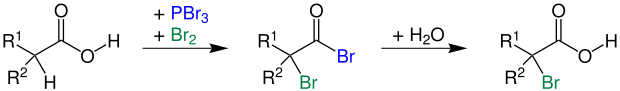
R1 = Alkylgruppe; R2 = Wasserstoff, Alkylgruppe
Mechanismus
Der Mechanismus wird hier anhand der Reaktion einer Carbonsäure mit Phosphor(III)-bromid und Brom veranschaulicht:
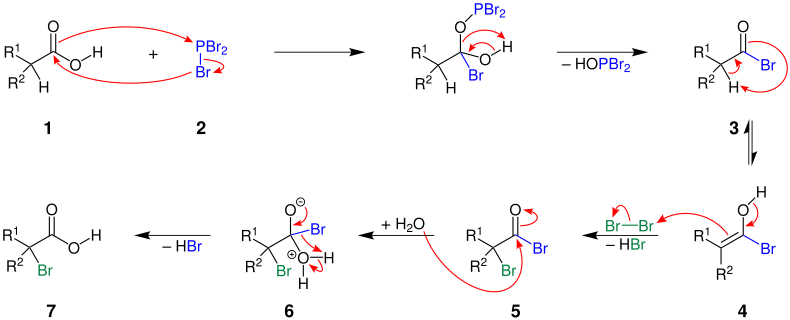
R1 = Alkylgruppe; R2 = Wasserstoff, Alkylgruppe
Die Carbonsäure 1 reagiert mit Phosphortribromid (2) über einen Zwischenschritt zu einem Carbonsäurebromid 3. Dieses tautomerisiert zur Enolform 4. Bei der Reaktion mit Brom bildet sich unter Abspaltung von Bromwasserstoff ein α-Bromcarbonsäurebromid 5. Die Carbonylgruppe in 5 wird nun von einem Wassermolekül angegriffen. Über die Zwischenstufe 6 entsteht die α-Bromcarbonsäure 7 – wobei Bromwasserstoff abgespalten wird.
Anwendungen
Aus α-Halogencarbonsäure lassen sich diverse Derivate herstellen:
- α-Hydroxysäuren durch eine Reaktion mit Natriumhydroxid
- α-Aminosäuren durch eine Reaktion mit Ammoniak
- Malonsäurederivate durch Reaktion mit Natriumcyanid und anschließender Hydrolyse des Nitrils
Siehe auch
Literatur
- H. Beyer, W. Walter: Lehrbuch der Organischen Chemie. 23. überarb. und aktualisierte Auflage. S. Hirzel Verlag, Stuttgart/Leipzig 1998, ISBN 3-7776-0808-4.
- L. Kürti, B. Czakó: Stratigic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2 S. 200.
- Reinhard Brückner, Reaktionsmechanismen: organische Reaktionen, Stereochemie, moderne Synthesemethoden, 3. Aufl., aktualisiert und überarb., korr. Nachdr. Spektrum Akad. Verl, Berlin 2007, ISBN 3-8274-1579-9, S. 494.
Weblinks
- Eintrag in www.organische-chemie.ch
Einzelnachweise
- ↑ a b c Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1371 f.
- ↑ C. Hell: Ueber eine neue Bromirungsmethode organischer Säuren. In: Ber. Dtsch. Chem. Ges. Band 14, 1881, S. 891–893, doi:10.1002/cber.188101401187.
- ↑ J. Volhard: Ueber Darstellung α-bromirter Säuren. In: Justus Liebigs Ann. Chem. Band 242, Nr. 1–2, 1887, S. 141–163, doi:10.1002/jlac.18872420107.
- ↑ N. Zelinsky: Ueber eine bequeme Darstellungsweise von α-Brompropionsäureester. In: Ber. Dtsch. Chem. Ges. Band 20, Nr. 1, 1887, S. 2026, doi:10.1002/cber.188702001452.
- ↑ Michael B. Smith: March's Advanced Organic Chemistry. Wiley & Sons, 7. Auflage, 2013, ISBN 978-0-470-46259-1, S. 672–673.
- ↑ Reinhard Brückner: Reaktionsmechanismen: organische Reaktionen, Stereochemie, moderne Synthesemethoden. 3. Aufl., aktualisiert und überarb., korr. Nachdr. Spektrum Akad. Verl, Berlin 2007, ISBN 3-8274-1579-9, S. 494.
- ↑ L. Kürti, B. Czakó: Stratigic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2, S. 200.
- ↑ T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 182–184.

